Genomeditierung mit
CRISPR/Cas
Pflanzenzüchtung
beschleunigen!
Revolutionär gut!
Neue Züchtungstechniken in der Pflanzenzüchtung
Die Genschere CRIPR/Cas: Präzise Veränderungen im Erbgut
Kaum ein anderes Thema elektrisiert die Pflanzenforschung zurzeit mehr als die neuen Züchtungsmethoden – im Mittelpunkt dabei: die sogenannte Genomeditierung mit der Genschere CRISPR/Cas.
Mit diesem neuen Verfahren können DNA-Bausteine im Erbgut einfach und präzise verändert werden. Kein Verfahren zuvor war dazu in der Lage. Und es funktioniert praktisch bei allen Lebewesen, obwohl die Genschere aus Bakterien stammt. Damit sind medizinische Anwendungen denkbar, etwa zur Therapie von Krebs, Infektionskrankheiten wie AIDS oder Erbkrankheiten. Aber nicht zuletzt profitiert die Pflanzenzüchtung enorm von den neuen Möglichkeiten
2020 erhielten Jennifer Doudna und Emmanuelle Charpentier den Nobelpreis für ihre bahnbrechende Entdeckung. Zu Recht: CRISPR/Cas ist sicherlich die bisher wichtigste Entdeckung in der Biologie im 21. Jahrhundert und wird von vielen als revolutionär gefeiert.
Doch in Europa kommt die Genomeditierung in der Praxis kaum voran. Andere Länder sind längst weiter. Welche Chancen die Genomeditierung für die Pflanzenzüchtung bietet und was der nutzbringenden Anwendung dieser Technologie immer noch im Weg steht, will dieses ThemenSpecial beleuchten.
In der Wissenschaft ist man sich jedenfalls einig: Führende Wissenschaftsorganisationen international und national - in Deutschland beispielsweise die Deutsche Forschungsgemeinschaft (DFG) und die Deutsche Akademie der Naturforscher Leopoldina - sprechen sich mit Nachdruck für eine Nutzung der neuen Technologie in der Pflanzenzüchtung aus.
Ein kurzer Überblick zum Thema:






CRISPR/Cas: Punktgenau!
So funktioniert die Schere
Woher kommt eigentlich die Genschere?
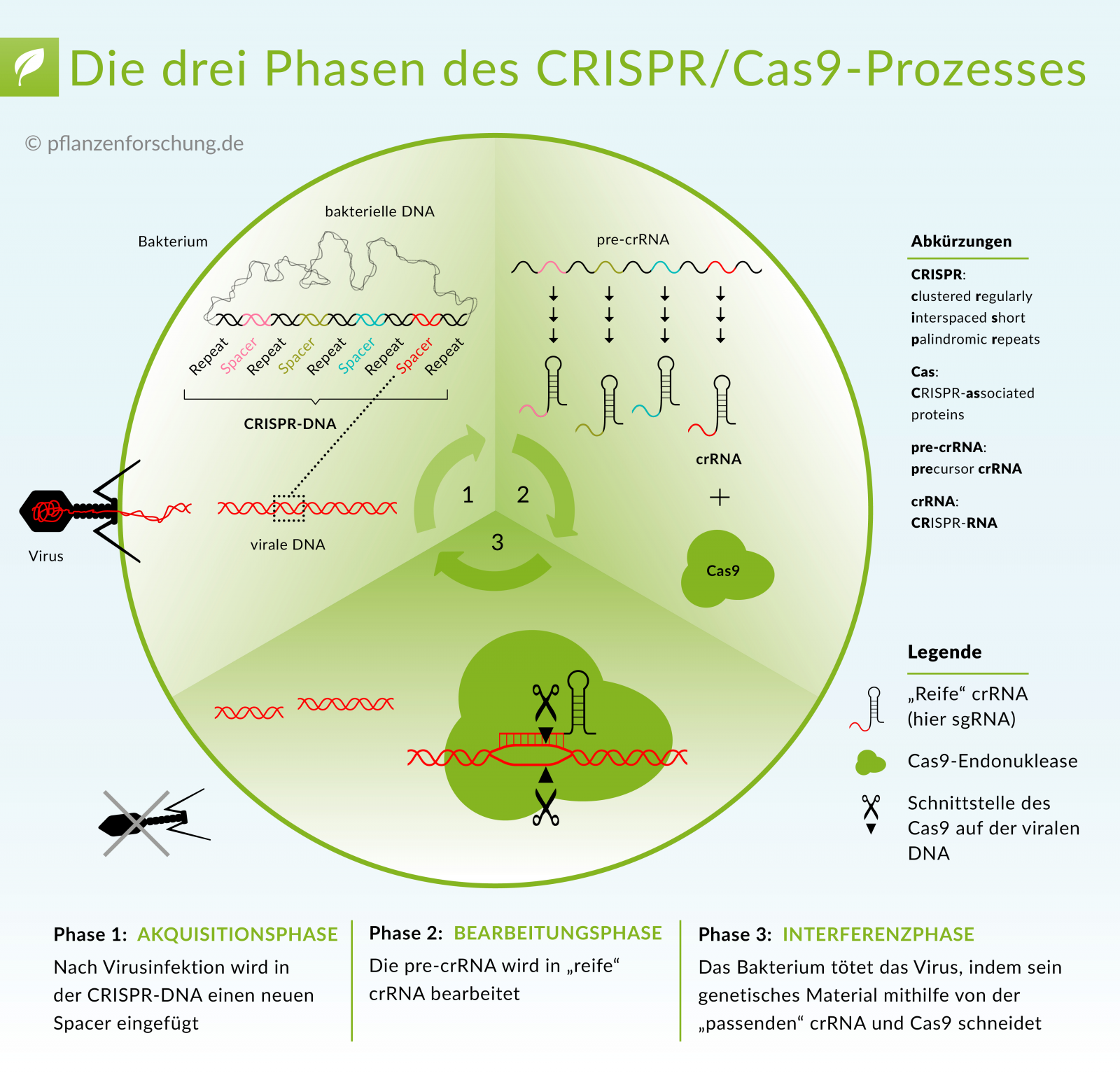
Das Genschere CRISPR/Cas9 ist eine natürliche Komponente des Immunsystem von bestimmen Bakterien. Bei einen Virusbefall integriert das Bakterium einen Erbgutabschnitt des Erregers in seine eigene DNA. Damit baut sich das Bakterium quasi ein immunologisches Gedächtnis auf und kann so erkennen, welche Viren es bereits befallen haben.
Wird das Bakterium erneut vom gleichen Virus befallen, wird der CRISPR/Cas9-Komplex aktiv und zerschneidet das virale Erbgut. Damit wird das Virus inaktiviert. Das CRISPR/Cas9-System ist somit ein natürliches System und keine Erfindung des Menschen. Für die Entdeckung dieser Mechanismen erhielten Emmanuelle Charpentier und Jennifer Doudna 2020 den Nobelpreis für Chemie.
Wie funktioniert die Genschere bei Pflanzen?
Mit den neuen Methoden der Genomeditierung, insbesondere der „Gen-Schere“ CRISPR/Cas, stehen den Züchtern neue Werkzeuge zur Verfügung, die erstmals zielgenaue Veränderungen im Genom ohne großen zeitlichen und finanziellen Aufwand ermöglichen.
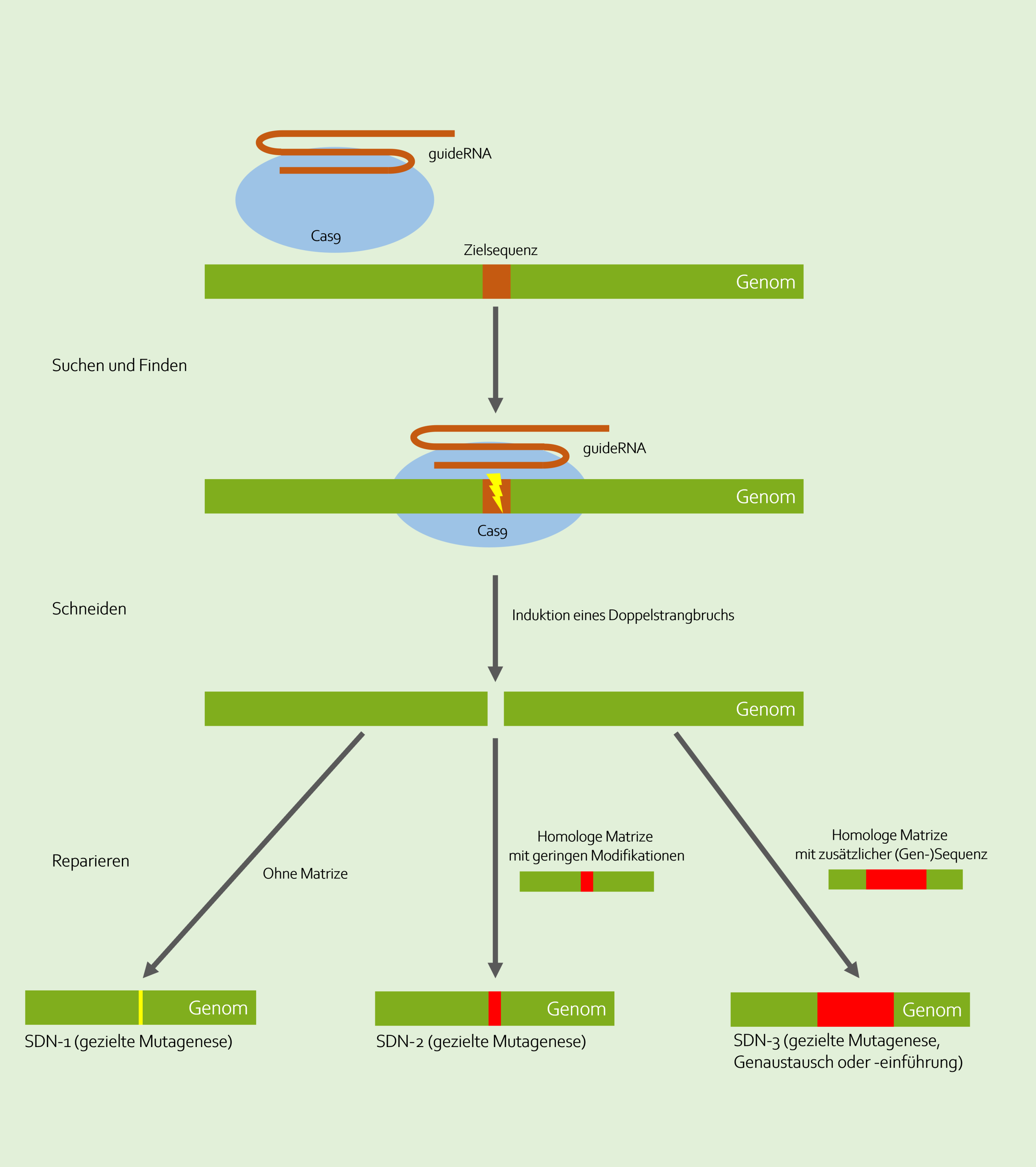
Dieses „CRISPR-Werkzeug“ besteht im Wesentlichen aus einem Stück RNA (Guide-RNA), das zielgerichtet an eine gewünschte Stelle im Genom bindet und einem gekoppelten „Schneide“-Protein (Cas9). Drei Schritte führen dabei zur Genomeditierung (siehe auch Abbildung unten).
1. Suchen und Finden
Zunächst einmal muss die Zielsequenz in einem riesigen Fundus von DNA-Sequenzen des Genoms einer Pflanze aufgespürt werden. Ausschlaggebend ist dafür die Basenabfolge der Zielsequenz, die als Erkennungsmerkmal dient. Erkannt wird diese bei der Genschere CRISPR/Cas von speziell programmierten RNA-Molekülen (guideRNA), die im Verbund mit den „Schneide“-Protein (Cas9) an die Sequenz präzise andocken.
2. Schneiden
An der Zielsequenz angekommen beginnt das Restriktionsenzym Cas9 mit seiner Arbeit: das exakte Schneiden der DNA an der vorher festgelegten Stelle. Es entsteht ein Doppelstrangbruch in der DNA.
3. Reparieren
Die eigentliche Veränderung der DNA kommt aber erst jetzt. Es beginnt damit, dass zelleigene Reparatur-Enzyme versuchen, den Schaden an der DNA zu beheben. Dabei kann es im unterschiedlichen Ausmaß zu Veränderungen der Genomsequenz kommen, die in drei Kategorien (SDN1-3) eingeteilt werden:
SDN1: Gibt es keine zusätzliche Reparaturvorlage für die Zelle, können beim zelleigenen Reparatursystem kleine Fehler entstehen: Es entstehen Punktmutationen, die z.B. das betroffene Gen inaktivieren.
SDN2: Die Reparatur erfolgt anhand einer Reparaturvorlage (einem zusätzlich in die Pflanzenzelle eingebrachten synthetischen Oligonukleotid). Die Genomsequenz ist im Vergleich zur Ursprungssequenz aber nur gering verändert (nur wenige Nukleotide).
SDN3: Die Reparatur erfolgt mit einer erweiterten Reparaturvorlage, die ganze Gene der eigenen Art oder Fremdgene enthalten kann.
Die Einteilung in diese drei Kategorien ist auch wichtig für die Sicherheitsbewertung der genomeditierten Pflanzen. So werden in vielen Ländern Pflanzen der Kategorie 1 (SDN1) als grundsätzlich sicher eingestuft, weil Punktmutationen auch auf natürliche Weise oder mit Hilfe konventioneller Züchtungsverfahren wie der Mutationszüchtung entstehen können. Aber auch zum Beispiel genomeditierte Pflanzen der Kategorie SDN3 können als sicher eingestuft werden, wenn das neue Gen bereits im Genpool einer Kulturpflanzenart natürlicherweise vorhanden ist.
Mehr Geschwindigkeit!
Die Genschere beschleunigt die Pflanzenzüchtung
Züchtung unter Druck
Viele unserer Kulturpflanzenarten sind genetisch verarmt – die Konsequenz einer oft „einseitigen“ Züchtung von Elitesorten in den letzten Jahrzehnten, die vor allem eins zum Ziel hatte: hohe Erträge und Anpassung an lokale Bedingungen. Diese Züchtungsziele sind per se nicht zu verurteilen, haben doch Hochertragssorten die Ernährung der Weltbevölkerung lange Zeit sichergestellt.
Doch dabei wurden sukzessive die Genpools vieler Kulturarten eingeengt. Gene für Eigenschaften wie Krankheits- und Schädlingsresistenzen, Nährstoffeffizienz oder für eine höhere Widerstandskraft gegenüber Hitze- oder Trockenstress blieben oft auf der Strecke.
Doch die Voraussetzungen haben sich nun grundsätzlich verändert. Mit der Farm-to-Fork-Strategie und dem Green Deal der Europäischen Union sollen bis 2030 die Mengen an Pflanzenschutzmitteln und Dünger um 50 bzw. 30 Prozent zurückgefahren werden. Ziel: Mehr Nachhaltigkeit, Arten- und Gewässerschutz. Der chemische Pflanzenschutz und die Mineraldüngung sind damit langfristig ein Auslaufmodell und neue Strategien für den Pflanzenbau erforderlich. Bis 2050 soll die Landwirtschaft auch noch klimaneutral werden. Hinzu kommen neue Erregertypen, die sich mit dem Klimawandel oder durch die zunehmende genetische Einengung des Genpools von Kulturpflanzen weltweit ausbreiten – ein Beispiel ist die pandemische Ausbreitung des Weizenbranderregers in Südamerika, Afrika und Asien. Und natürlich trifft der Klimawandel die Pflanzen direkt und sorgt zunehmend für Ertragseinbußen.
Was nun?
Diese Optionen hat die Züchtung
Wie können Kulturpflanzen in naher Zukunft ohne Pflanzenschutz und weniger Düngung auskommen und dem Klimawandel trotzen - und dennoch hohe Erträge liefern? Um die zukünftigen Sorten fit für die aktuellen Herausforderungen zu machen, gibt es für Züchter:innen verschiedene Optionen. Alle sind darauf ausgerichtet, die genetische Vielfalt der Kulturarten wieder zu erhöhen und gezielt verlorengegangene Eigenschaften „zurückzuholen“ - oder sogar neue positive Eigenschaften mit Hilfe der Pflanzenforschung zu erzeugen.
Drei Züchtungstechniken im Vergleich: Kreuzungszüchtung, ungerichtete Mutageneseverfahren und die Genomeditierung.
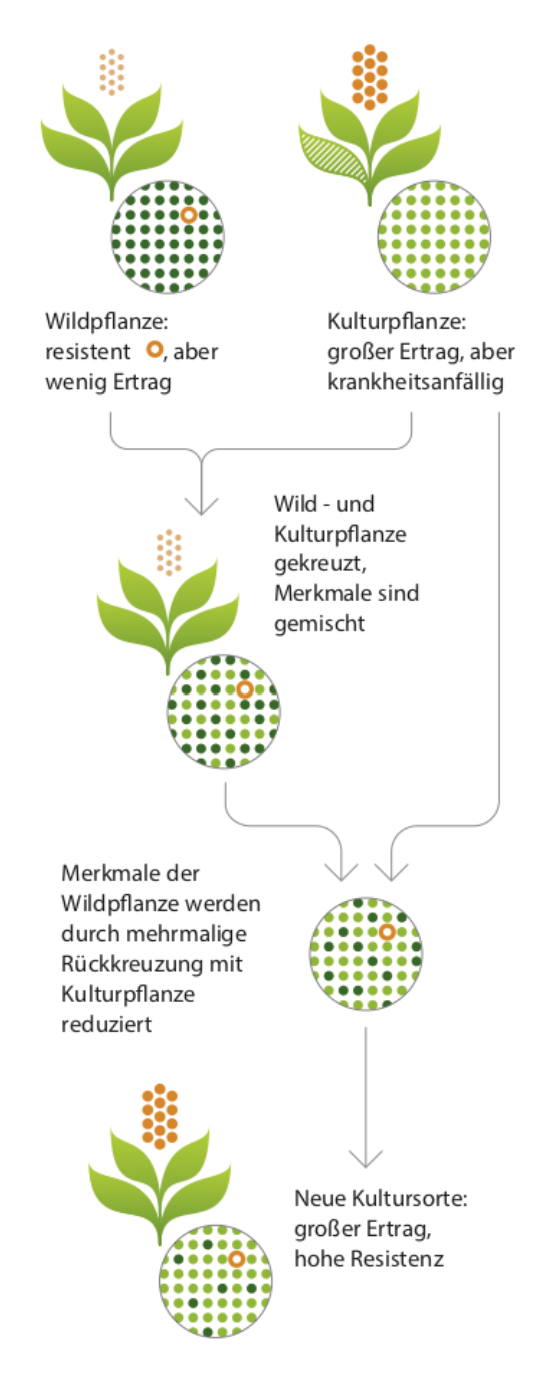
Option 1: Kreuzungszüchtung
Zeitintensiv und manchmal in der Sackgasse
Oft haben Züchter:innen in ihrer Sortensammlung keine Spenderpflanze mehr für ein gewünschtes Merkmal, z. B. eine bestimmte Resistenz gegen eine Pflanzenkrankheit. Dann suchen sie im sogenannten erweiterten Genpool nach geeigneten Merkmalsträgern. Das sind Wildverwandte der Kulturpflanzen oder alte Sorten (z.B. sogenannte Landsorten), die züchterisch weniger stark bearbeitet wurden. Oft finden sich solche „alten“ Pflanzen gesichert in Genbanken wie der Bundeszentrale Ex-situ-Genbank beim IPK in Gatersleben.
Hat sich eine geeignete Akzession mit der gewünschten Eigenschaft gefunden, beginnt eigentlich erst das Problem. Durch sein sonstiges Eigenschaftsprofil entspricht eine alte Sorte oder gar Wildpflanze nicht den Anforderungen an Ertrag, Verarbeitungseigenschaften oder anderen Resistenz- oder Toleranzeigenschaften – für den Anbau völlig ungeeignet.
Daher muss durch Kreuzung die gewünschte Eigenschaft in eine moderne Sorte übertragen werden. Doch dabei vermischen sich die „guten“ Eigenschaften einer modernen Sorte mit vielen unerwünschten Eigenschaften der alten Sorte oder Wildart (Donorpflanze).
Und jetzt beginnt eine über viele Jahre andauernde Arbeit der Züchter:innen: Sie müssen die Kreuzungsnachkommen immer wieder mit der modernen Sorte kreuzen, um die unerwünschten Gene bzw. Eigenschaften der Donorpflanze sukzessive zu entfernen – und damit außer dem Wunschgen quasi den Rest der genetischen Information der Donorpflanze.
Aber das benötigt nicht nur sehr viele Jahre, sondern kann auch grundsätzlich scheitern. Wenn das Wunschgen des Donors mit weiteren unerwünschten Genen des Donors gekoppelt ist („linkage drag“, in diesem Bereich besteht keine ausreichende Rekombination bei der Meiose, um die Gene zu trennen), werden keine geeigneten Rückkreuzungnachkommen entstehen. In diesem Fall ist das Züchtungsprojekt gescheitert. Doch selbst bei einem Erfolg ist eine direkte Nutzung in der Züchtung noch nicht gesichert und es können Leistungsdepressionen bei anderen Merkmalen auftreten.
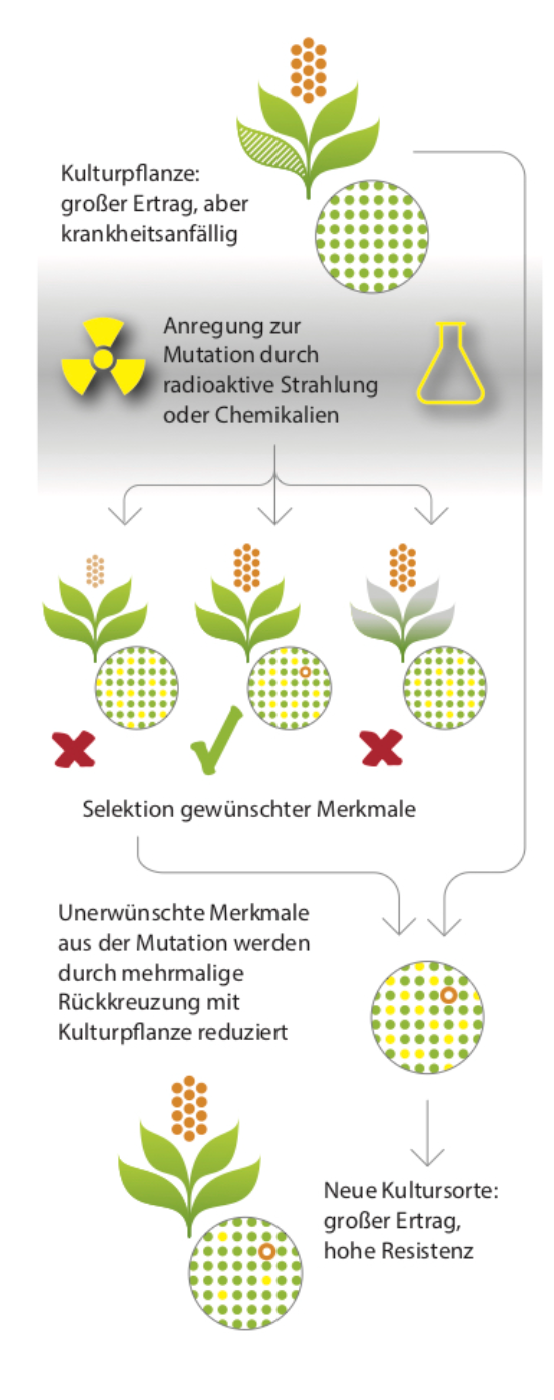
Option 2: Die ungerichtete Mutagenese
Mit Chemikalien oder Strahlen schrotschussartig Punktmutationen ins Genom einführen
Es kann natürlich sein, dass keine Wildverwandte oder alte Sorte mit der gewünschten Eigenschaft gefunden wird. Dann hatten Züchter:innen bislang noch eine andere Option: Künstliche Erhöhung der genetischen Vielfalt innerhalb einer Kultursorte mittels ungerichteter Mutagenese.
Dafür wurden bisher beispielsweise radioaktive Strahlung (Gamma- oder Neutronenstrahlen) oder chemische Agentien genutzt, die über das gesamte Genom verteilt zufällige Mutationen auslösen. Je nach Behandlungsdauer und Intensität entstehen hunderte oder tausende Punktmutationen verteilt über alle Genom- bzw. Genbereiche. Nur mit einer sehr geringen Wahrscheinlichkeit wird ein Gen getroffen, dass durch seine Mutation auch das gewünschte neue Merkmal ausprägt. Falls dieser Glückstreffer gelingt, bleibt noch ein anderes Problem:
Da die ungerichtete Mutagenese zu einer unüberschaubaren Zahl von unerwünschten Mutationen und Effekten in anderen Erbgutabschnitten oder Genen führt, müssen Züchter:innen auch hier wieder durch langwieriges und wiederholtes Rückkreuzen die unerwünschten Mutationen entfernen oder zumindest beachtlich reduzieren.
Zwischen 1965 und 1990 ist die durch atomare Strahlung ausgelöste Mutagenese systematisch in der Pflanzenzüchtung eingesetzt worden. Nach einer Aufstellung der Internationalen Atomenergiebehörde sollen etwa 3000 neue mit dieser Methode erzeugte Pflanzensorten auf den Markt gekommen sein. Zu den Produkten gehören ein Großteil der Hartweizensorten, die für die Herstellung von Pasta verwendet werden, viele andere Getreidesorten sowie Sorten von Obst, Gemüse und Hülsenfrüchten.
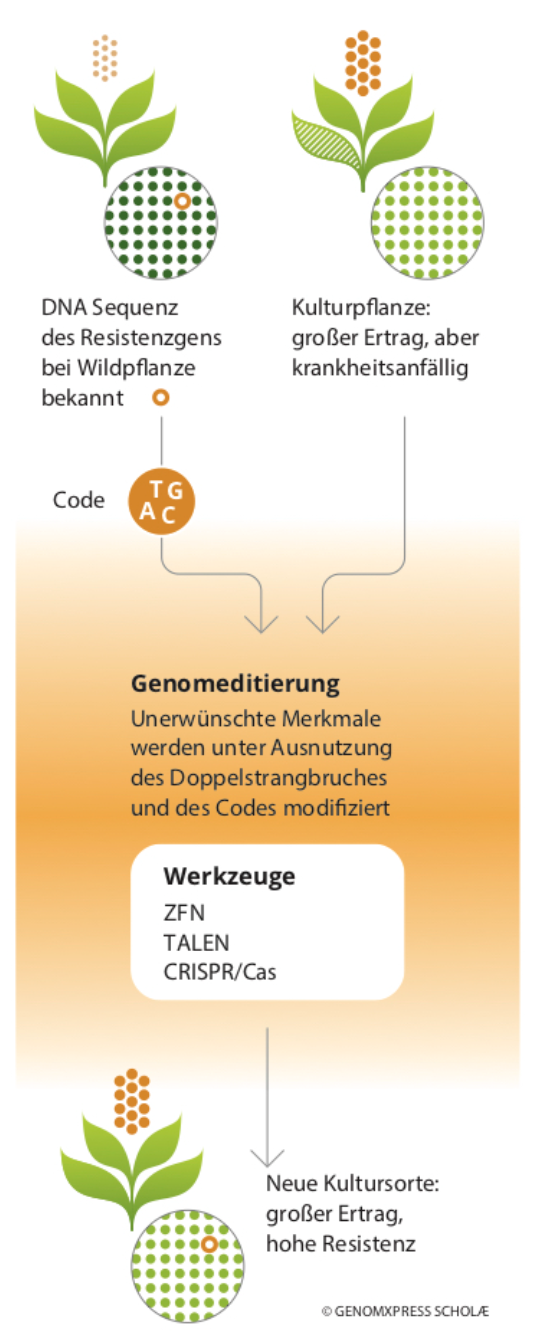
Option 3: Genomeditierung mit der Genschere
Rückkreuzungen nicht mehr nötig
Bei den Werkzeugen für die Genomeditierung, umgangssprachlich auch Genscheren genannt, handelt es sich um verschiedene molekulare Systeme, mit denen einzelne Bausteine des Erbguts jeglicher Lebewesen gezielt und präzise umgeschrieben, also gewissermaßen editiert werden können. Die am häufigsten genutzte Genschere ist das bereits vorgestellte CRISPR/Cas9-System.
Die Nutzung von Genomeditierungstechniken kann im Vergleich zu den vorangegangen beschriebenen Methoden viele Jahre Züchtungsarbeit einsparen und zudem die dort beschriebenen unerwünschten „Nebenwirkungen“ vermeiden. Durch die gezielte Modifikation eines Zielgenes in einer modernen Sorte entfallen die besonders aufwändigen Rückkreuzungsschritte und die Sorte bleibt 100%-prozentig frei von unerwünschten „Wildgenen“ oder unerkannten negativen Mutationen.
Der Einsatz der Genscheren führt zu einer enormen Zeitersparnis bei der Züchtung. Schätzungen von Expertinnen und Experten zufolge können je nach Pflanzenart mit Genomeditierung im Vergleich zu konventionellen Züchtungsverfahren zwischen sechs und 50 Jahren eingespart werden.
DFG-Präsidentin Professorin Dr. Katja Becker: „Neue molekulare Züchtungstechniken erlauben eine bisher nie dagewesene Präzision und Effizienz in der Verbesserung von Nutzpflanzen. Dieses Potenzial sollte zur Erreichung der Nachhaltigkeitsziele ausgeschöpft werden.“
Mehrere aktuelle Forschungsprojekte zeigen eindrucksvoll, wie sich die Genschere bewährt hat und langjährige Rückkreuzungen überflüssig macht:
Gerste: Die Resistenz aus der Genbank
"Anfälligkeitsgen" ausgeschaltet
Lange Zeit war es Züchtern gelungen, Wintergerste gegen das Gerstengelbmosaikvirus zu verteidigen. Jetzt gerät diese Resistenz durch neue Varianten des Erregers in Gefahr. Die Erreger erzeugen ein gelbes Mosaik auf den Blättern, verringern die Winterhärte und behindern im Frühjahr Wachstum und Bestockung. Auf befallenen Feldern kann sich der Ertrag dadurch halbieren.
Ein Forschungsteam unter Leitung des Leibniz-Instituts für Pflanzengenetik und Kulturpflanzenforschung (IPK) hat nun die Genschere zur direkten Erzeugung resistenter moderner Sorten genutzt. Zuvor war bereits bekannt, dass alte Landrassen mit einem ausgeschalteten Gen PROTEIN DISULFIDE ISOMERASE LIKE 5-1 (PDIL5-1) eine höhere Widerstandskraft gegen die Erreger haben.
Das Gen ist ein sogenannter Anfälligkeitsfaktor, den Viren nutzen, um sich im pflanzlichen Gewebe zu vermehren. In seiner ursprünglichen Funktion ist das Genprodukt daran beteiligt, Proteine in die richtige 3D-Struktur zu bringen.
Statt die resistenten Landrassen mit modernen Sorten zu kreuzen, schaltete das Forschungsteam mittels der Genschere CRISPR/Cas9 dieses Gen direkt in modernen Elitesorten aus: im Wintergerstekultivar „Igri“ und im Frühjahrsgerstekultivar „Golden Promise“. Beide Kultivare sind bekanntermaßen anfällig für das Gerstengelbmosaikvirus.
Die geneditierten Sorten erwiesen sich als resistent gegen aus dem Boden aufgenommene Gerstenmosaikviren. Bei der Wintergerste bildeten die editierten Pflanzen im Gewächshaus vergleichbar viele und schwere Körner. Eine Mutation der Frühjahrsgerste besaß sogar ein erhöhtes Korngewicht. Damit liegen nun ideale Linien vor, um in einem künftigen Forschungsprojekt die Pflanzen im Feld- und Stresstest zu erproben – was jedoch aufgrund des geltenden Gentechnikrechts praktisch unmöglich ist.
Hoffie, R., et al. (2022): „Novel resistance to the Bymovirus BaMMV established by targeted mutagenesis of the PDIL5-1 susceptibility gene in barley“. In: Plant Biotechnology Journal, pp. 1-11 (2022). doi: 10.1111/pbi.13948.
Mehltau-resistente Reben
Im Weinbau sind der Echte und Falsche Mehltau gefürchtete Pilzkrankheiten, die bei entsprechender Witterung (längere Regenperioden) den gesamten Ertrag eines Weinberges gefährden können. Die Pilze befallen die grünen Teile der Reben und führen zu kleinen und ausgetrockneten Trauben. Bislang helfen den Winzer:innen hauptsächlich nur Schwefel- und Kupferfungizide, im konventionellen Weinbau auch chemische Fungizide. Der Verbrauch von Fungiziden ist dabei im Weinbau sehr hoch und pilzresistente Rebsorten noch nicht weit verbreitet.
Pilzresistente Rebsorten – bisher nicht einfach zu erzeugen
Es gibt bislang nur wenige Rebenlinien mit wirkungsvollen Resistenzgenen und das klassische Einkreuzen dieser Linien in etablierte Sorten wie Riesling, Pinot Noir und Co. gestaltet sich langwierig und nachteilig für die Weinqualität. Denn durch das Einkreuzen gelangen zur Hälfte die Gene der resistenten Linie in die Kreuzungsnachkommen – und diese bedingen ein stark verändertes Weinaroma. Erst nach zahlreichen Rückkreuzungsschritten erreicht der Wein wieder eine akzeptable Qualität, aber die charakteristischen sensorischen Eigenschaften der ursprünglichen Sorte gehen verloren. Dieser Prozess benötigt darüber hinaus auch ca. 20 Jahre. Auch hier kann die Genomeditierung die Lösung sein, da keine Kreuzungsschritte mehr notwendig sind.
Ausschaltung von „Empfindlichkeitsgenen“
So gelang einem Forschungsteam durch gezieltes Ausschalten von mehreren sogenannten „Empfindlichkeitsgenen“ einer Rebsorte – diese Gene bzw. Genprodukte nutzen die Erreger für eine erfolgreiche Infektion der Pflanze – die Resistenz der Rebe stark zu erhöhen. Die Symptome einer Mehltauinfektion reduzierten sich um über 90 Prozent. Die genomeditierten Pflanzen enthalten keinerlei fremdes Erbgut oder fremde Proteine.
Quelle: Olivares F et al. (2021) CRISPR/Cas9 targeted editing of genes associated with fungal susceptibility in Vitis vinifera L. cv. Thompson Seedless using geminivirus-derived replicons. Frontiers in Plant Sciences 12. doi: 10.3389/fpls.2021.791030
Feuerbrandresistente Apfelbäume
Auch die Resistenzzüchtung bei Apfelbäumen hat ähnliche Schwierigkeiten und Herausforderungen. So verbreitet sich das Feuerbrandbakterium, ein aus den USA stammender Erreger, seit einigen Jahrzehnten auch in Europa. Die Bäume sterben innerhalb weniger Wochen bis Jahre an der Infektion. Die Infektionen sind sehr schwierig zu bekämpfen, zumal wirksame Antibiotika im Pflanzenschutz nur in Ausnahmefällen als Pflanzenschutzmittel erlaubt sind.
Die beliebtesten Sorten wie Braeburn, Gala oder Golden Delicious sind hochanfällig gegenüber dem Erreger. Die Einkreuzung von resistenten Sorten ist mit den gleichen Schwierigkeiten verbunden wie bei der Rebenzüchtung – zahlreiche Rückkreuzungsschritte über einen Zeitraum von bis zu 20 Jahren sind notwendig, um wieder eine akzeptable Fruchtqualität zu erzeugen.
Ähnlich wie beim vorangegangenen Beispiel der Resistenzzüchtung bei Reben haben Wissenschaftler:innen ein Empfindlichkeitsgen des Apfelbaums - MdDIPM4 – gezielt mit der Genschere CRISPR/Cas ausgeschaltet. Bei Feuerbrandinfektionen zeigten die genomeditierten Apfelbäume 50 Prozent weniger Symptome.
Quelle: Pompili V et al. (2019) Reduced fire blight susceptibility in apple cultivars using a high-efficiency CRISPR/Cas9-FLP/FRT-based gene editing system. Plant Biotechnology Journal (3): 845-858. doi: 10.1111/pbi.13253
Tomaten: Resistenz gegen den Jordanvirus
Der Jordanvirus ist ein relativ neuer Erreger von Tomatenpflanzen, der erstmals 2014 in Israel entdeckt wurde. Seitdem breitet sich das Virus weltweit aus, 2018 wurden die ersten Infektionen auch in Europa nachgewiesen. Aufgrund seiner großen Schäden ist er ein meldepflichtiger Quarantäneorganismus, der bisher nicht bekämpft werden kann. Lediglich das Entfernen und Verbrennen infizierter Pflanzen bremst seine Ausbreitung.
Das Virus gehört zur Gruppe der Tobamoviren und aus Experimenten mit der Modellpflanze Arabidopsis war bereits bekannt, dass das Virus für seine Vermehrung die pflanzlichen Gene TOM1 und TOM2 benötigt.
Mittels Genomeditierung hat daher eine Forschungsgruppe die fünf Varianten von TOM1 in der kommerziellen Tomatensorte Craigella ausgeschaltet. Nach Infektion der Pflanzen konnte das Virus nach einigen Tagen nicht mehr nachgewiesen werden, während nicht-editierte Pflanzen einen starken Virusbefall aufwiesen.
Quelle: Ishikawa M et al. (2022) Tomato brown rugose fruit virus resistance generated by quadruple knockout of homologs of TOBAMOVIRUS MULTIPLICATION1 in tomato. Plant Physiology 189 (2): 679-686. doi: 10.1093/plphys/kiac103
Kartoffeln: Resistenz gegen Kraut- und Knollenfäule
Die Kraut- und Knollenfäule (Phytophthora infestans) ist weltweit die mit Abstand bedeutendste Krankheit der Kartoffel. Dieser Erreger war im 19. Jahrhunderts Ursache einer großen Hungersnot in Irland und damit auch verantwortlich für den Tod von mehr als einer Million Iren.
Um Kartoffeln vor der Kraut- und Knollenfäule zu schützen, setzten Landwirt:innen sieben- bis achtmal, in nassen Jahren sogar bis zu zwölfmal, chemische Fungizide ein.
Das Einkreuzen von Resistenzgenen z.B. aus Wildkartoffeln hat auch hier den großen Nachteil, dass die Wildkartoffelgene die Qualität der Kreuzungsnachkommen deutlich verschlechtern. So nimmt beispielsweise der Gehalt an giftigen Glykoalkaloiden zu. Notwendige Rückkreuzungen sind sehr zeitaufwändig.
Mittel Genomeditierung konnten bei der Kultursorte Desirée zwei Empfindlichkeitsgene ausgeschaltet werden, ohne die Entwicklung und das Wachstum der Pflanzen zu beeinträchtigen.
Quelle: Kieu NP et al. (2021) Mutations introduced in susceptibility genes through CRISPR/Cas9 genome editing confer increased late blight resistance in potatoes. Scientific Reports 11: 4487. doi: 10.1038/s41598-021-83972-w
Weizen: Reduktion des Glutengehaltes
An Zöliakie, eine Unverträglichkeit gegenüber dem Kleberweiß Gluten in vielen Getreideprodukten, leidet etwa ein Prozent der Bevölkerung. Das Gluten verursacht starke Entzündungen im Dünndarm. Die Betroffenen müssen Lebensmittelprodukte mit Weizen, Roggen und Gerste meiden. Da eine ausgewogene Ernährung dadurch deutlich schwerer umzusetzen ist, kommt es bei den Patienten oft auch zu einer Unterversorgung an bestimmten Nährstoffen.
Die Züchtung von glutenfreien Weizen ist bisher nicht gelungen. Grund dafür ist, dass eine Vielzahl von Genen im Weizengenom enthalten sind, die für Glutene (Gliadine und Glutenine) codieren. Mit der konventionellen und ungerichteten Mutationszüchtung könnten prinzipiell diese Gene ausgeschaltete werden. Aber um die dabei zwangsläufig auch entstehenden zahlreichen unerwünschten Mutationen wieder zu entfernen und alle Gluten codierenden Gene zu inaktivieren, wären zahlreiche Mutationsschritte sowie äußerst aufwändige Kreuzungs- und Rückkreuzungsschritte notwendig. Experten sind sich einig, dass dies beim hochkomplexen Weizengenom ein aussichtloses Unterfangen wäre.
Ein erfolgversprechender Ansatz ist die Genomeditierung. Bislang gelang es mit dieser Methode, 35 von 45 Gliadin-Gene zielgerichtet auszuschalten und damit den Gliadin-Anteil im Brotweizen um 82 Prozent zu senken. Eine weitere Senkung ist noch erforderlich, damit keine Zöliakie mehr ausgelöst wird. Auch muss dabei noch beachtet werden, dass bestimmte „gute“ Glutenanteile erhalten bleiben: Sie sind dafür verantwortlich, dass der Weizen seine Backfähigkeit behält.
Quelle: Sanchéz-León S et al. (2017) Low-gluten, nontransgenic wheat engineered with CRISPR/Cas9. Plant Biotechnology Journal 16 (4): 902-910. doi: 10.1111/pbi.12837
Sicher
- weil präzise und weniger Mutationen
Genetische Variation ist bei jeder Züchtungsmethode die Basis
Seit der Entdeckung der Mendelschen Vererbungsgesetze im Jahr 1865 hat die Pflanzenzüchtung zahlreiche technologische Durchbrüche erlebt, angefangen von der gezielten Kreuzungszüchtung und Hybridzucht bis hin zur Mutationszüchtung. Eine weitere Welle von Innovationen wurde im letzten Viertel des 20. Jahrhunderts durch technologische Fortschritte in der Molekularbiologie eingeleitet.
Die Grundlage der Pflanzenzüchtung ist immer die genetische Variation: die Verfügbarkeit unterschiedlicher Genvarianten. Diese Varianten sind das Ergebnis genetischer Veränderungen im Genom einer Pflanze, die entweder zufällig auf natürliche Weise entstehen oder künstlich ausgelöst werden.
Spontane Mutationsraten
Spontane genetische Veränderungen treten in jeder Generation einer Pflanze auf und resultieren aus natürlichen Prozessen wie Kopierfehlern der genetischen Informationen während der Zellteilung und externen Faktoren wie Strahlung von Sonnenlicht. Es wird geschätzt, dass in einer einzigen Weizenpflanze ungefähr 238 spontane genetische Veränderungen in jeder Generation auftreten. Somit sind alle Pflanzen auf einem Feld genetisch unterschiedlich - allein durch natürliche Mutation.
Chemische und Strahlen-Mutagenese
Die Fähigkeit, neue Pflanzensorten mit wünschenswerten Eigenschaften auszuwählen, war lange
Zeit durch das Ausmaß solcher spontaner („natürlicher“) genetischer Veränderungen begrenzt. Die ersten Versuche, die genetische Variation durch technische Mittel zu erhöhen, fanden in der Mitte des 20. Jahrhunderts statt. Pflanzenzüchter begannen, ionisierende Strahlung (z.B. Röntgenstrahlen, Gammastrahlung) und Chemikalien (z.B. Äthylmethansulfonat) zu verwenden, um Tausende von zufälligen genetischen Veränderungen im Erbgut einer Pflanze einzuführen, ein Prozess, der als Mutationszüchtung bekannt ist und als konventionelle Züchtungsmethode gilt - also nicht dem Gentechnikrecht unterliegt.
Die Mutationszüchtung hat maßgeblich zur Entwicklung von Nutzpflanzensorten mit verbesserten Eigenschaften beigetragen. In der Datenbank für mutierte Sorten der Joint FAO/IAEA sind mehr als 3000 Pflanzensorten aufgeführt, die unter Verwendung ionisierender Strahlung erzeugt wurden. Viele der Pflanzen, die wir heute konsumieren, stammen tatsächlich von solchen Pflanzensorten ab.
Beispiele hierfür sind die Gerstensorte "Golden Promise" (hoher Ertrag, verbesserte Mälzung), Hartweizen (für Brot und Pasta), krankheitsresistente japanische Birne, dunkelrosa Grapefruit, halbzwergiger Reis, krankheitsresistente Bohne, Erdnüsse mit festeren Schalen sowie Sorten von Erbsen, Baumwolle, Pfefferminze, Sonnenblumen, Erdnüssen, Grapefruit, Sesam, Bananen, Maniok und Sorghum.
Genomeditierung
Hier reiht sich nun auch die neue Methode der Genomeditierung ein. Pflanzensorten, die mit Hilfe dieser neuen Methode gezüchtet wurden, lassen sich von konventionell gezüchteten Sorten nicht unterscheiden, sofern keine artfremden Gene eingebracht werden. Die wenigen punktuellen Veränderungen (in vielen Fällen nur eine Punktmutation), die die neuen Sorten im Erbgut tragen, könnten auch zufällig oder durch konventionelle Züchtungsmethoden wie der Mutationszüchtung entstehen.
Ihr Risikopotenzial für die Umwelt und menschliche Gesundheit ist somit nicht erhöht. So die einhellige Meinung führender Wissenschaftsorganisationen in Deutschland (Deutsche Forschungsgemeinschaft, Nationale Akademie der Wissenschaften Leopoldina, Union der deutschen Akademien der Wissenschaften) und vieler anderer wissenschaftlicher Organisationen weltweit.
Vergleich der Mutationsraten pro Pflanzengeneration
Natürliche Mutationsrate:
- Weizen: 238
- Mais: 32
- Tomate: 13
Mutationsrate bei der Mutagenesezüchtung (durch Strahlen / Chemikalien):
- ca. das 1000-fache der natürlichen Mutationsrate
Einfache Genomeditierung (SDN1):
- eine zusätzliche Mutation
Der Wissenschaftliche Dienst des Europäischen Parlaments hat deshalb festgehalten, dass die Risiken genomeditierter Pflanzen prinzipiell niedriger sind als die Risiken von Pflanzen, die mit konventioneller Mutagenese (mittels Chemikalien oder radioaktiver Strahlung) gezüchtet wurden. Denn bei der klassischen Mutagenese werden auf zufällige Weise gleich mehrere Tausend Veränderungen induziert, deren Auswirkungen nicht in jedem Einzelfall überprüft werden. Bei der Genomeditierung: meist nur eine Mutation an bekannter Stelle.
Genomeditierungs-Datenbank
Welche Pflanzen gibt es bereits?
Forschung an über 60 Kulturarten
Ein Netzwerk aus 134 europäischer Wissenschaftsinstituten hat eine interaktive, öffentlich zugängliche Datenbank (eusage) für genomeditierte Modell- und Nutzpflanzen aufgebaut. Damit sollen sowohl die Zivilgesellschaft als auch politische Entscheidungsträger maximal transparent über den Stand der Forschung informiert werden.
Die Datenbank umfasst veröffentlichte Forschungsarbeiten, bei denen genomeditierte Pflanzen entstanden sind. Die Autoren fanden bislang mehr als 740 Anwendungen von Genomeditierung bei 63 verschiedenen Pflanzenarten. Die häufigsten Pflanzen, in absteigender Reihenfolge, waren Reis (Oryza sativa), Tomate (Solanum lycopersicum), Mais (Zea mays), Soyabohne (Glycine max) und Weizen (Triticum aestivum).
Die Liste der Länder mit den meisten Fachpublikationen wird deutlich angeführt von China (409 Studien), dahinter folgen die USA (158), Japan (37) und Südkorea (33). Fast 90 Prozent der Pflanzen in der Datenbank wurden mit Hilfe der Genschere CRISPR/Cas gentechnisch verändert.
Der Großteil der veränderten Eigenschaften lässt sich diesen fünf Gruppen zuordnen:
- Merkmale zur Steigerung des Pflanzenertrags und -wachstums (166 Studien)
- Verbesserung der biotischer Stresstoleranz (z.B. Resistenz gegenüber Krankheitserregern) (134 Studien)
- Verbesserung der abiotischer Stresstoleranz (z.B. erhöhte Widerstandskraft gegen Trockenheit, Versalzung, Klimawandel) (60 Studien)
- Verbesserter Lebens- und Futtermittelqualität (169 Studien)
- Neue Merkmale für die industriellen Nutzung der Pflanzen (102 Studien)
Es wird auch hier deutlich, dass die Erforschung und Entwicklung neuer genomeditierter Pflanzen in Europa hinter anderen Ländern zurückhängen. Grund dafür ist unter anderem die bislang restriktive Haltung der Europäischen Union in Bezug auf Pflanzen, die mit neuen Züchtungsmethoden wie der Genomeditierung verändert worden sind. Bisher dürfen diese in der EU praktisch nicht im Freiland getestet und angebaut werden, da sie rechtlich unter das Gentechnikgesetzt fallen und ein langes und und sehr teures Zulassungsverfahren durchlaufen müssen. Zudem haben sich viele Mitgliedsstaaten grundsätzlich gegen den Anbau von solchen Pflanzen ausgesprochen. Das ist eine beträchtliche Hürde, die auch dazu führt, dass selbst Forschungsprojekte im Bereich der Grundlagenforschung auf die Genomeditierung als Werkzeug verzichten.
Genomeditierte Pflanzen in den Startlöchern
Welche geneditierte Kulturpflanzensorten werden jetzt schon in anderen Ländern kommerziell angebaut oder sind zumindest bereits in einem fortgeschrittenen Entwicklungsstadium? Das lässt sich nicht einfach beantworten. In den großen Agrarexportländern außerhalb der EU – zum Beispiel die USA, Kanada, Brasilien, Australien – werden inzwischen die meisten genom-editierten Pflanzen wie konventionell gezüchtete eingestuft. Sie benötigen dann keine besondere genrechtliche Zulassung und dürfen meist ohne Auflagen angebaut werden – entsprechend unübersichtlich ist die Lage.
Hier noch einmal zur Erinnerung: Erst 2011 wurde die Genschere entdeckt und bereits jetzt sind erste genomeditierte Kulturpflanzen im kommerziellen Anbau. In den USA wachsen beispielsweise genomeditierte Raps- und Sojasorten mit neuen Eigenschaften auf den Feldern. Im Frühjahr 2018 begann der kommerzielle Anbau einer Sojabohne der Firma Calyxt, deren Fettsäureprofil mit einer Genomeditierungsmethode verändert wurde. Sie enthält weniger gesättigte Fettsäuren, dafür deutlich mehr der gesundheitlich wertvolleren Ölsäure. Genomeditierter Weizen, Mais oder Kartoffeln werden folgen, bald wohl auch Zitrusfrüchte oder Erdnüsse.
Ist das Gentechnik?
Recht international
Reformen angemahnt
Nach zurzeit gültigem EU-Gentechnikrecht – das auf den wissenschaftlichen Kenntnisstand der 1990er-Jahre zurückgeht - gelten alle genomeditierten Pflanzen als gentechnisch veränderte Organismen. Entsprechend ist die Zulassung für Freilandversuche und den kommerziellen Anbau dieser Pflanzen mit hohen Hürden belegt: Jahrelange Zulassungsverfahren und hohe Kosten, die oft einen sehr hohen siebenstelligen Betrag für die Antragsteller überschreiten.
Eine Studie der EU-Kommission im Jahr 2021 sowie zahlreiche Wissenschaftsorganisationen haben bereits klargestellt, dass das europäische Gentechnikrecht in diesem Punkt nicht mehr zeitgemäß ist. Es ist für die neuen Genomeditierungstechnologien vollkommen ungeeignet und muss dringend novelliert werden – auch in Hinsicht auf die großen Potenziale dieser Technik, die Landwirtschaft nachhaltiger zu gestalten. Sie weisen darauf hin, dass „Produkte der neuen Züchtungstechniken – soweit sie ohne das dauerhafte Einbringen fremden Genmaterials auskommen und sich auf das Hervorrufen von Mutationen beschränken – nicht unterscheidbar von Produkten der herkömmlichen Züchtung sind. Die Genomeditierung von Pflanzen bedeute somit kein höheres Risiko als seit Jahrzehnten etablierte und nicht regulierte Techniken.“
Diese Argumentation hat nun auch die EU-Kommission übernommen und im Juli 2023 einen neuen Gesetzentwurf zu genomeditierten Pflanzen vorgelegt.
Der EU-Kommissionsvorschlag
Der Vorschlag zur Reform der Gentechnikrechts sieht vor, dass einfache genomeditierte Pflanzen der Kategorie NGT1 (NGT steht für New Genomic Techniques), die ausschließlich Genmaterial aus dem Genpool der eigenen Art enthalten, von den geltenden Auflagen des Gentechnikrechts befreit werden. Eine weitere Einschränkung ist, dass die Pflanzen gegenüber der Ausgangspflanze höchstens 20 eingefügte oder veränderte Basenpaare enthalten dürfen. Für entfernte Nukleotide gibt es jedoch keine Limits. Und bei der neuen Eigenschaft der Pflanze darf es sich nicht um eine Herbizidresistenz handeln – eine Regelung, die im Einklang mit dem Ziel der EU steht, den Einsatz von Pflanzenschutzmitteln bis zum Jahr 2030 um 50 Prozent zu senken. Eine Gentechnik-Kennzeichnungspflicht entfällt für diese Pflanzen und daraus hergestellter Produkte.
Für stärker modifizierte genomeditierte Pflanzen (Kategorie NGT2) soll weiterhin das Gentechnikrecht und die entsprechenden Auflagen gelten. Nur wenn keine plausiblen Hinweise auf Risiken vorliegen und die neuen Merkmale den Nachhaltigkeitszielen des European Green Deal dienen (z.B. Trockentoleranz, Krankheitsresistenzen, höhere Erträge), soll das Zulassungsverfahren erleichtert werden.
Europa als Nachzügler
Die von der EU-Kommission vorgeschlagene Neuausrichtung der gesetzlichen Auflagen für genomeditierte Pflanzen ist weitgehend im Einklang mit den bereits existierenden Regularien anderer Länder.
Die großen Agrarexportländer in Süd- und Nordamerika, aber auch zahlreiche asiatische Länder haben bereits die Regeln für Zulassung und Anbau genomeditierter Pflanzen nach dem Stand der Wissenschaft liberalisiert. Diese werden nicht mehr pauschal den Gesetzen unterworfen, die seit vielen Jahren für "klassische" gentechnisch veränderte Pflanzen gelten. Im Kern orientieren sich dabei fast alle Länder am breiten wissenschaftlichen Konsens, wie er sich in den letzten Jahren herausgebildet hat:
- Ist in einer genom-editierten Pflanze keine Fremd-DNA vorhanden und hätte sie auch unter natürlichen Bedingungen durch zufällige Mutation entstehen können, ist sie wie eine konventionell gezüchtete Pflanze zu bewerten und zuzulassen.
- Sind jedoch mit Hilfe von Genomeditierungsverfahren fremde Gene oder größere DNA-Abschnitte ins Genom eingefügt worden, fallen solche Pflanzen unter das Gentechnik-Gesetz oder zumindest unter einen Zulassungsvorbehalt.